 |  |

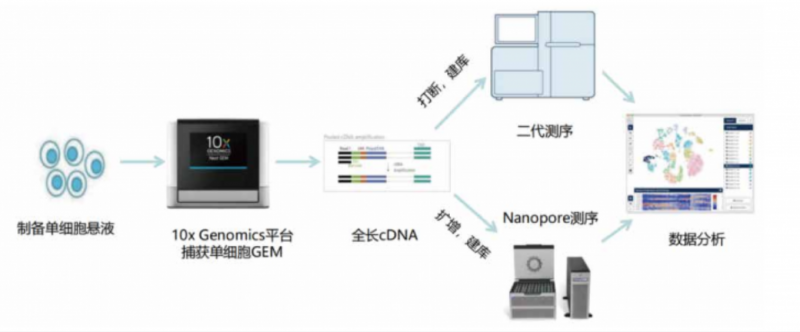
單細胞測序技術為基礎科研、臨床診斷、藥物研發等領域提供了諸多全新發現視角。現階段主流的單細胞測序,大多是基于 10X?Genomics、BD Rhapsody 等單細胞捕獲設備獲得 cDNA 后進行打斷、擴增、建庫,并用二代測序分析基因的整體定量。然而,基因在不同組織、不同細胞亞群中會使用 mRNA 的不同轉錄本,同時也包括 InCRNA;此外 SNV、融合基因等結構變異也具有組織和細胞特異性,目前基于二代測序的單細胞數據局限于 3'或 5' 端的 100~150bp,因此較難滿足這類需求:而傳統的 Smart-seq 雖然可以實現全長轉錄本覆蓋,但轉錄本結構分析需要經過組裝且細胞通量較低,成本較高,研究單細胞水平的可變剪切仍然較為困難。
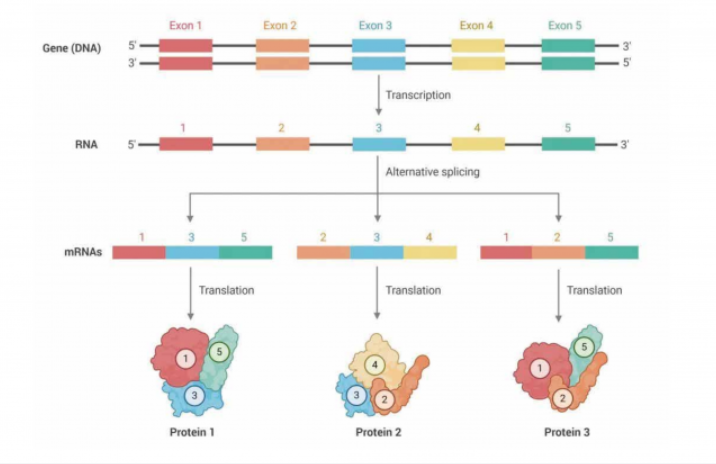
三代測序如 Pacbio、Nanopore 等技術能夠以其長讀長的優勢解決這一痛點。因此,如果能將二代測序與三代測序相結合,既能獲得 mRNA 的全長序列,并通過 Cell?Barcode 信息定位到細胞亞群,即可解決這一單細胞研究領域的痛點。但是,我們在前期測試中發現,二代單細胞測序一般獲得約 3 萬個基因的表達矩陣,三代全長測序能獲得超過 10 萬個轉錄本的表達矩陣,兩套數據的聚類圖譜差異巨大,現有的分析流程并未很好的解決兩套數據的整合問題。因此,如何從龐大的二代 + 三代,也即基因 + 轉錄本的單細胞數據中,挖掘到有價值的特異性轉錄本,能夠為單細胞臨床轉化、藥物靶點發現帶來更加精細的挖掘角度。

伯豪生物基于十多年的單細胞組學服務經驗,可提供從樣品保存、運輸、單細胞懸液制備,到單細胞分選、建庫和數據分析的解決方案。同時,及智醫學團隊出身單細胞科研服務行業,重點圍繞單細胞富集與檢測平臺、單細胞測序技術平臺和基于 AI 算法的單細胞數據分析算法平臺。建立了單細胞轉錄組、空間轉錄組、單細胞聯合 Bulk 多組學等多種獨特的分析流程和方法,尤其擅長各類免疫細胞與基質細胞的分類、功能解析、細胞互作、藥物靶點篩選等分析項目。最終通過積累的上百種單細胞分析方法與百萬級別單細胞數據庫,為單細胞臨床轉化類項目提供專業研發服務。團隊生信專家通過高效的自動化分析腳本,并歷時數月的二代 + 三代單細胞算法測試,目前已經解決了二代 + 三代單細胞聚類的諸多分析難點。
伯豪生物與及智醫學強強聯合,正式推出單細胞全長轉錄本測序服務,即單細胞 cDNA 水平的轉錄、遺傳變異研究,通過一次捕獲,兩次建庫,同時獲得單細胞聚類與轉錄本信息:
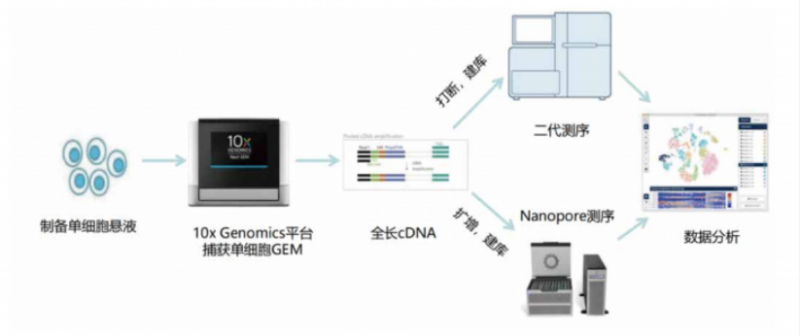
目前,該技術方向為如下科研問題,提供了潛在的解決辦法:
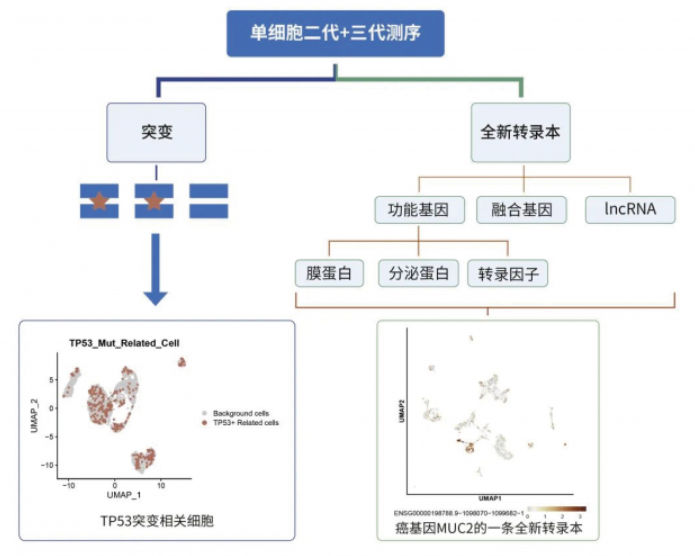
1、發現不同細胞攜帶的突變,攜帶突變的細胞與非突變細胞相比、攜帶不同突變類型的細胞相比,挖掘基因表達規律;
2、挖掘功能基因,如膜蛋白、分泌蛋白、轉錄因子等編碼基因的轉錄本使用情況,并發現全新功能的轉錄本;
3、發現融合基因所在的細胞亞群,研究它們與其它腫瘤細胞的擬時序分化關系;
4、發現亞群特異性的全新 IncRNA;
5、獲得亞群特異性表達的轉錄本,能夠輔助小核酸類藥物開發企業,針對該特異性轉錄本設計 siRNA 干擾片段,提升小核酸干擾靶點的有效性。
案例解析
2021 年 11 月 11 日,來自澳大利亞 ? 沃爾特 - 伊麗莎霍爾醫學研究所的 Tian 等人開發了一種基于 Nanopore 測序和 10X?Genomics 的全長轉錄組單細胞測序方法,分析單細胞中的全長異構體、可變剪接和突變檢測。研究成果發表在國際知名期刊 GenomeBiology (IF=13.6),論文題目為 "Comprehensive?characterization?ofsingle-cell?full-length?isoforms?in?human?and?mouse?with?long-read?sequencing"。
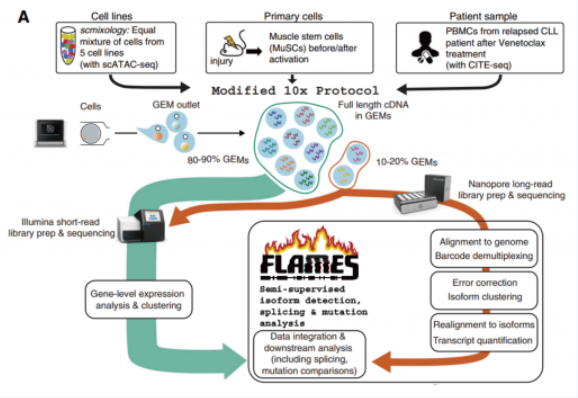
文章中,使用 10X Genomics 技術分選得到單細胞的全長 cDNA 后,將 cDNA 一分為二,一份進行打斷建庫用于二代測序,另一份進行全長擴增建庫用于 Nanopore 三代測序。此時 Nanopore 的文庫上也包含了細胞 Barcode, 后續可以通過分析流程將三代測序和二代測序結果通過細胞 Barcode 一 一 對 應。通過這樣的方式,即實現了獲得全長轉錄本,分析亞群的特征性轉錄本使用,并同時拿到了突變所在細胞。

文章數據分析顯示其中 40%-60% 的 Nanoporereads 可以分配給預期的 Barcode, 并保留用于后續分析(圖 C)。在數據處理過程中,非全長且不能唯一分配給轉錄本的數據被丟棄。最終每個細胞的平均 UMI 為 10,000 至 60,000 個,并且與對應的短讀數據情況相符(圖 D)。Nanopore 和 Ilumina 數據的基因水平的 UMI 計數也高度一致(圖 E)
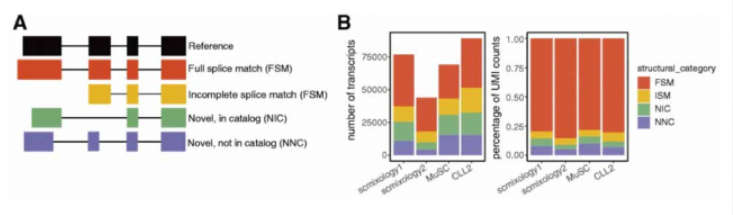
文章數據分析顯示其中 40%-60% 的 Nanoporereads 可以分配給預期的 Barcode, 并保留用于后續分析(圖 C)。在數據處理過程中,非全長且不能唯一分配給轉錄本的數據被丟棄。最終每個細胞的平均 UMI 為 10,000 至 60,000 個,并且與對應的短讀數據情況相符(圖 D)。Nanopore 和 Ilumina 數據的基因水平的 UMI 計數也高度一致(圖 E)
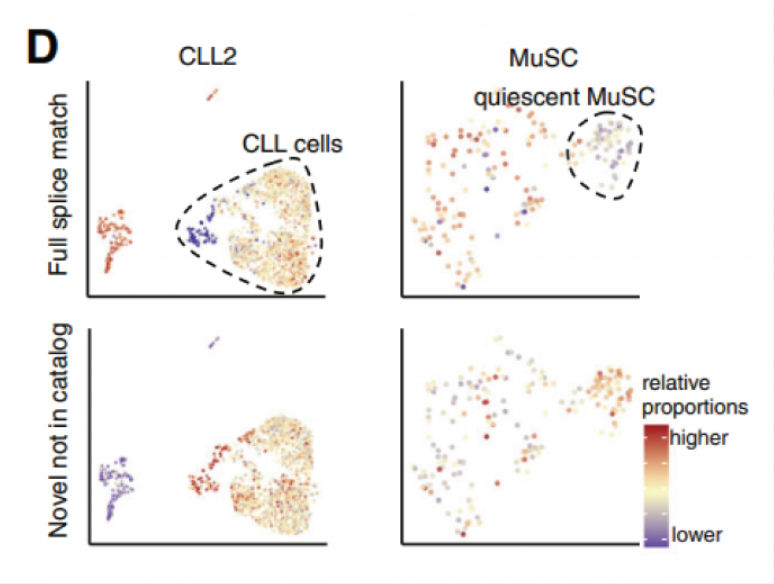
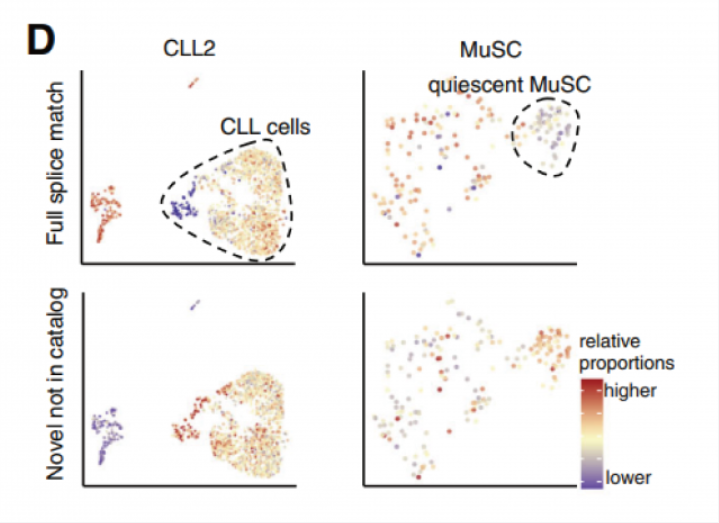
通過聚類分析發現,CLL(慢性淋巴細胞白血病)細胞相比正常免疫細胞具有更高比例的新型轉錄本,特別是新型剪接的轉錄本。同樣,相比激活的干細胞,靜態肌肉干細胞也有更高比例的新型轉錄本(圖 D)。
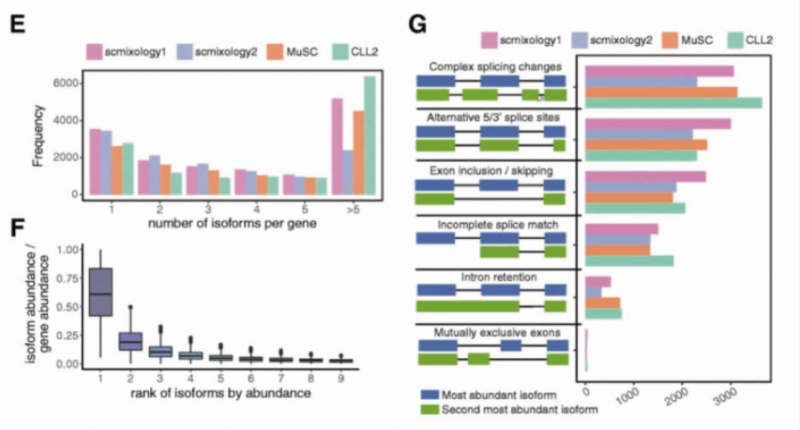
分析發現,約 80% 的基因可以表達多種轉錄本(圖 E),但是大多數基因主要表達 1 到 2 種轉錄本類型(圖 F),約 30% 的基因含有多于一種的可變剪接事件,意味著 2 個最高表達的異構體可能涉及多個外顯子的復雜剪接變化而產生不同。
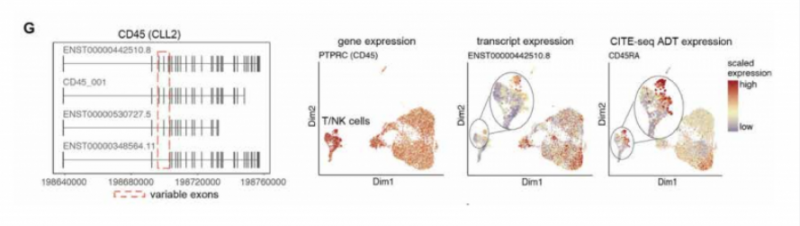
文章通過分析 CLL 數據,檢測到 CD45 的多種亞型(圖 G),CD45 的表達通過 CITE-seg 進行驗證。CITEseg 可以同時檢測 RNA 和細胞表面蛋白,這種方法結合三代測序,可以對細胞表面蛋白進行更深入的分析和探索。
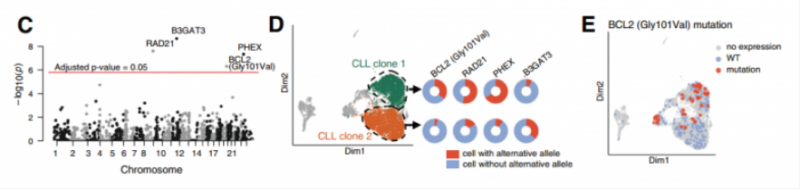
對 CLL 數據集進行分析,尋找只存在于癌細胞中的,且在不同的 CL 轉錄簇中具有不同等位基因頻率的 SNVS,通過經典的曼哈頓圖最終發現四個變異在不同的 CLL 聚類呈現顯著差異(圖 C, 圖 ?D)。其中發現的 Gly101Val 突變,此突變已被證實通過降低 BCL2 對 venetoclax 的親和力而使患者對 venetoclax 治療產生耐藥性,通過分析發現患者 CLL2 攜帶約 25% 的 GIV101Va| 突變,并發現該突變不僅屬于亞克隆,而且與特定的轉錄簇相關(圖 E)。
單細胞全長轉錄本測序的樣品選擇與實驗細節
由于單細胞全長測序需要對 mRNA 反轉錄后的 cDNA 全長進行測序,核心是需要將完整的全長 cDNA 擴增至 2ug 的 ?Nanopore 建庫起始量,而常規單細胞是將一鏈 cDNA 做基礎擴增后全部打斷用來做建庫測序,因此,這一實驗細節就意味著單細胞全長測序需要額外質控。
一、樣品選擇:
常規單細胞測序樣品來源分為新鮮采集與液氮速凍兩種類型,兩種類型的樣品需要兩種處理方式,新鮮采集樣品需要在 48h 內制備懸波并上機,液氮速凍樣品需要將細胞膜破碎,丟棄細胞質,分離提取細胞核,用單個核來做單細胞測序。
不過,由于細胞核里面的 RNA 大多為初始 RNA,包含有較多內含子,而從初始 RNA 加工為成熱 mRNA 的過程大多發生在細胞質中,因此,抽核類的項目并不太適用于單細胞全長測序。雖然在 2022 年 7 月份一篇 Nature?Biotechnoloey 的文章是對人腦抽核后的單細胞樣品進行三代全長測序,不過由于拿不到成熟 mRNA,文章是站在了特定基因在不同亞群的外顯子保留這樣的科研角度統計規律(如下圖)。文章角度非常新穎,也是科研界首次用單細胞全長測序發現,人腦中某些基因在不同亞群中使用不同的外顯子組合,生成多種編碼蛋白。不過,由于最終拿到的仍舊是細胞核內的 RNA,后續還需要大量驗證工作,因此抽核后做單細胞全長測序的臨床轉化價值較小。所以,單細胞全長測序的項目最適宜采集新鮮樣品制備細胞懸液,捕獲成熟 mRNA 開展后續驗證工作。
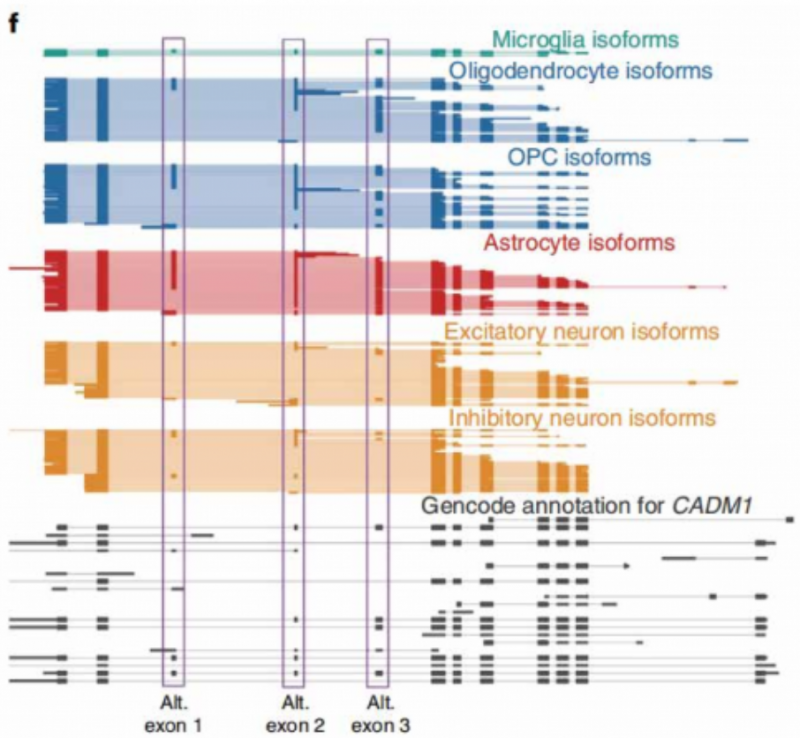
經三代單細胞全長測序發現 CADMI 基因在人腦神經元(興奮性、抑制性)、星膠、小膠、少突細胞亞群中,會使用不同的外顯子組合。原文也有用蛋白質譜技術對這些外顯子的多肽產物進行驗證的工作。
二、懸液質控:
在收集到新鮮樣品之后,可以使用單細胞組織保護液(伯優?單細胞組織保存液)將樣品在 24h-48h 內從臨床運輸至實驗室進行懸液解離,并通過顯微鏡、細胞計數儀檢測懸液質量。

由于全長單細胞對 RNA 質量要求較高,比較建議懸液活率在 85% 以上,同時用臺盼藍、AO/PI 雙染鑒定,并用顯微鏡仔細觀察細胞真實活率、紅細胞比例(紅細胞在光鏡下,可以觀察到圓餅狀的亮圈,中間有黑色小點,有經驗的單細胞實驗員可以通過肉眼觀察判斷出來,而不少品牌的細胞計數儀有可能會把紅細胞計算為碎片,甚至檢測不到)。
另外,現階段二代單細胞測序,單個樣品的數據量大多為 100G,可以容納 5000-8000 左右的細胞捕獲量;而三代測序成本較高,站在節省經費的角度,建議一方面準確的對細胞懸液的濃度進行測定(不可單純依靠細胞計數儀),來控制上機細胞總數(建議上機不超過 1 萬個細胞);同時也要結合不同品牌單細胞捕獲設備的真實捕獲率(這點最好找成熟單細胞科研服務公司來完成)來進行綜合判定(建議捕獲不超 5000 個細胞如果超過 5000 需要增加三代測序數據量)。
三、文庫制備
單細胞全長轉錄本測序,只需要一次捕獲,拿到一鏈 CDNA 之后要立刻進行全長擴增,如下圖:
? 因此,就需要將已擴增好的 cDNA 全長進行質控:
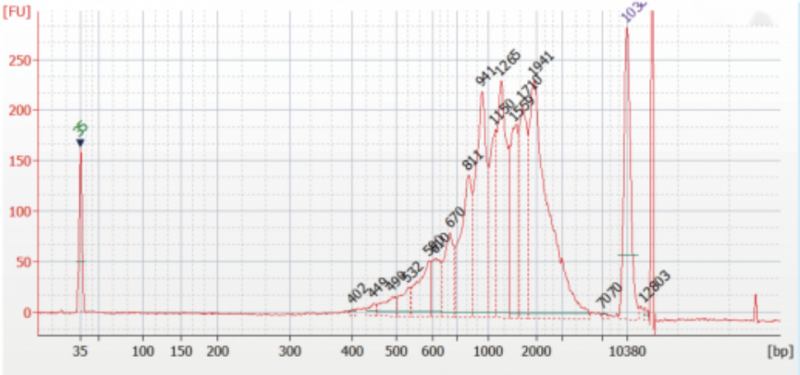
如上圖,cDNA 條帶主峰在 1 -1.5kb 左右,下一步可以聯系三代測序工廠寄送樣品,由他們進行建庫測序。但是,也要測序工廠及時反饋三代文庫的質檢圖片,要求文庫主峰與 cDNA 條帶主峰一致,方可進行正式的 Nanopore 上機測序實驗。
四、單細胞測序剩余樣本用于新的科研發現:
由于現階段三代全長測序的準確性不夠高,考慮到后續驗證工作,比較建議在單細胞上機之后,將剩余的細胞樣品進行凍存,從 DNA、RNA、蛋白三個層面開展后續驗證實驗:
1、DNA 水平:
在我們前期測試中發現,三代原始數據中基因單核苷酸結構變異 SNV(RNA 層面的 SNP、Indel)? 較多,為了拿到準確的,與 DNA 層面一致的突變信息,就需要結合 DNA 層面的檢測來共同篩選核心突變。有兩種做法:
第一,同時將腫瘤患者的外周血和單細胞實驗剩下的腫瘤細胞做全外顯子測序(兩個樣品的市場價合計不超 5000 元),通過 ? 腫瘤組織測出來的突變 ? 扣掉 ? 自身 PBMC? 的胚系突變,可以得到體細胞突變,將這些突變 ? 基因位點作為核心突變,利用自動化腳本,提取 ? 三代數據中的原始 reads,這些 reads 都帶有的 ?Cell?barcode 信息可以定位到突變所在的細胞與亞群!即可通過擬時序算法分析突變細胞 vs 非突變細胞的發育分化軌跡。
第二:做全基因組重測序(可以根據具體課題決定是否還需收集 PBMC),發現拷貝數變異 CNV,以及融合基因信息,將這些信息與三代全長進行聯合分析。后續分析內容也極為豐富,可以展開多個科研角度的解釋。
2、RNA 水平:
在三代全長拿到特征性轉錄本之后,還需要做后續驗證,如果序列較少,可以通過 5'RACE、3'RACE 實驗拉全長獲得準確序列;如果候選轉錄本序列較多,也可以通過 Pacbio 直接做 ?Bulk? 測序(可以混樣測一份即可,目的是拿到序列),再結合單細胞全長轉錄本的特異性表達規律,可以快速、低成本獲得這些序列的完整信息,下一步即可通過構建動物模型,開展功能驗證工作。
3、蛋白層面:
現階段的單細胞測序大多是以基因作為靶點,但是從已經發表的上萬篇單細胞數據中,也經常發現基因的表達特異性并不強,這個是現階段單細胞測序需要升級改進的核心關鍵點。而在真實組織中,基因在不同亞群中使用不同的轉錄本編碼多種蛋白產物。有了單細胞全長轉錄本技術,也就意味著可以將靶點發現從基因細化為轉錄本,挖掘轉錄本的蛋白編碼產物。因此,臨床轉化最核心的一步:膜蛋白層面,可以依靠全長轉錄本獲得一些全新的發現。
現有的蛋白質質譜技術無法做到 ? 針對單個細胞進行廣泛的蛋白質檢測,但是蛋白質的編碼序列都是從 RNA 層面的轉錄本翻譯過來,轉錄本序列的檢測比蛋白質的檢測要容易很多。所以,這個里面就依托一套簡單的邏輯:從 DNA 到 RNA 到蛋白的中心法則,即可做到通過單細胞全長轉錄本測序,發現亞群特異性轉錄本,再將轉錄本序列預測的多肽產物與蛋白質譜打出來的多肽產物進行匹配,發現一條潛在的轉錄本 + 編碼產物,即為一條新型潛在靶點。其實,在腫瘤新抗原發現領域,這套序列預測 + 質譜檢測的策略已經非常成熟并目較為實用,因此,可以基干中心法則將這套成熟策略轉用到單細胞全長轉錄本發現新型蛋白編碼產物領域。
總結
綜上所述,單細胞全長轉錄本更適合做新鮮樣品,整體實驗過程并不復雜,基本上現階段單細胞科技服務類公司都能實現,只需要在幾個細節上稍加注意即可。
總結下來,單細胞全長測序的本質只是對轉錄本加了 ? 細胞亞群 ? 的標簽,方便從數萬條轉錄本快速篩選到特異性表達的少數轉錄本。這個并不是一套全新開發的技術,只能算是從 DNA 到 RNA 到蛋白的一整套符合中心法則的單細胞多組學的技術方案。在我們前期拜訪前沿課題組的過程中,有不少研究員曾想過這樣的方法,只是行業內缺乏前人嘗試,我們深入思者過這些細節后,發現這套方案從樣品的選擇,測序實驗,數據呈現,均比現階段的單細胞二代測序更加實用,更加貼近臨床轉化。從另外一個角度,轉錄本是基因功能實現的最小細分單位,針對轉錄本研究的單細胞全長測序,算得上是轉錄組研究領域的終點站。
解析某腫瘤樣本單細胞全長轉錄本的實測數據
一、基礎質控
| 測序 | 二代測序 | 三代測序 |
| 測序數據量 | 100G | 100G |
| 總計測得 | 約 2 萬條基因 | 44834 種轉錄本 |
| 中位值 | 基因中位值:2906 | 轉錄本中位值:1720 |
詳細統計如下,實測基因是指在三代全長中測到的基因:
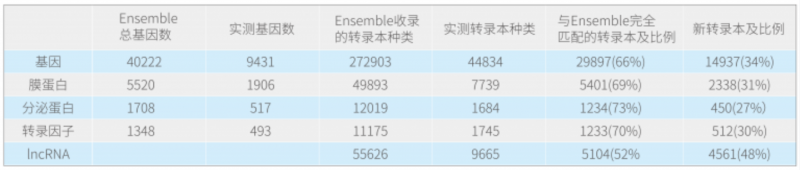
以膜蛋白為例,數據庫中收錄的人總膜蛋白有 5520 個,對應轉錄本有 49893 條;在該樣品中測到了 1906 個(大部分膜蛋白不一定會在該腫瘤中表達),對應轉錄本是 7739,其中與 Ensemble 完全匹配的轉錄本有 5401 條,新轉錄本 2338 條,意味著平均每個膜蛋白會表達 1 條新轉錄本。從總體統計來看,功能基因(膜蛋白、分泌蛋白、轉錄因子)會約 30% 的新轉錄本,IncRNA 由于目前數據庫收錄的并不多,所以有約 50% 的新 IncRNA。
二、轉錄本表達的可靠性:
如同二代單細胞測序一樣,三代全長測序同樣會統計每條轉錄本在該樣品中測到的總 count 數,截圖如下:
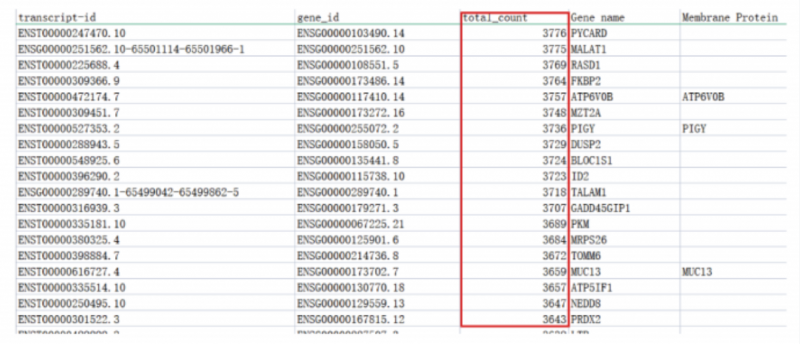
目前已經發表的 SCI 文章,轉錄本 total?count>5 即可納入正常聚類分析,經過實測建,議設置轉錄本 total?count>20(約占總轉錄本的 80%),作為驗證實驗的可靠候選。
三、轉錄本表達的特異性
單細胞全長轉錄本測序的一大核心應用,是發現亞群的特征性轉錄本。單細胞二代 + 三代的合并聚類、注釋如下:
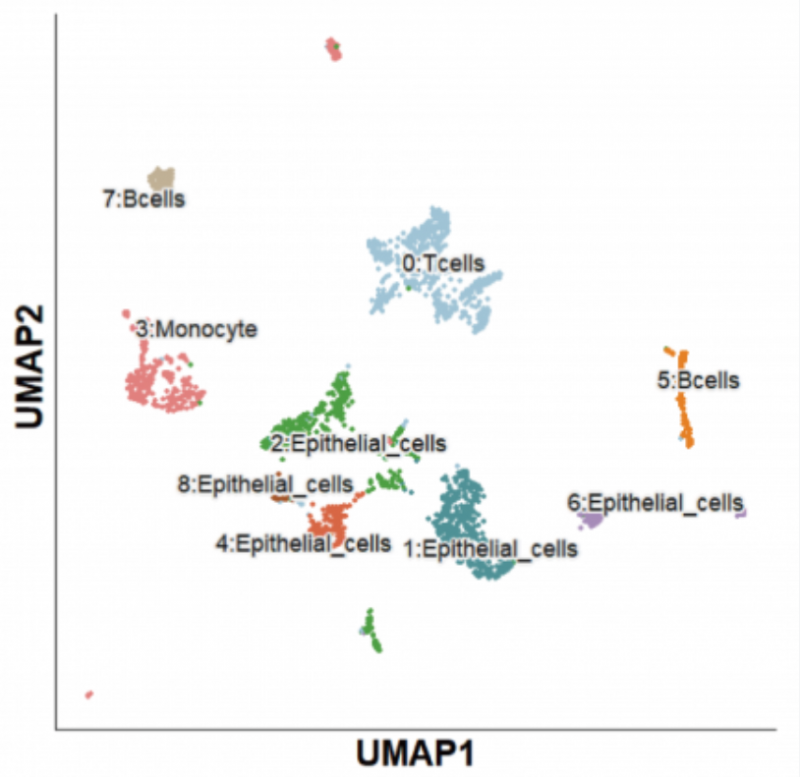
總計分 B ?cels、T?cels、Monocyte?cells、Epithelial?cells 四大群。更精細的注釋,如 Memory?B、Treg、Naive?T、ExhaustT、Mac 等我們會在后續章 節陸續展開討論。
以 CART 治療領域的某明星分子 MUC1 為例,二代測序基因表達情況如下如下:
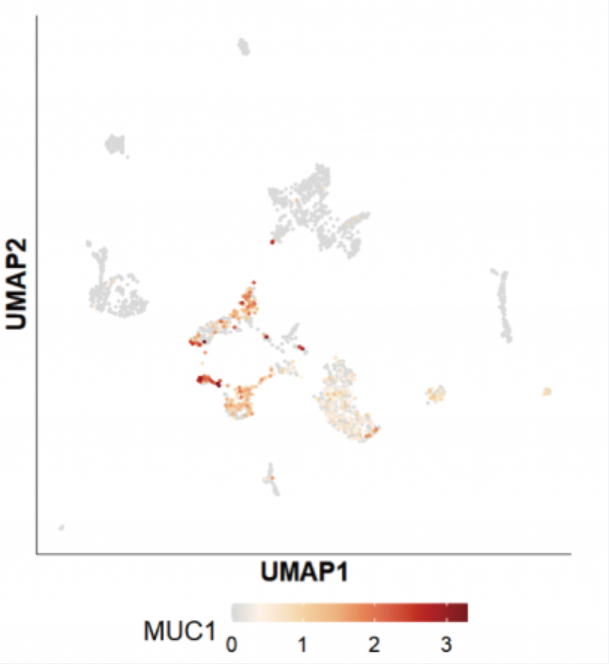
不過,該基因在三代全長測序中,并未測到該基因的轉錄本,下文有對此類現象的討論。
另外一個明星癌基因 MUC2 的表達展示:
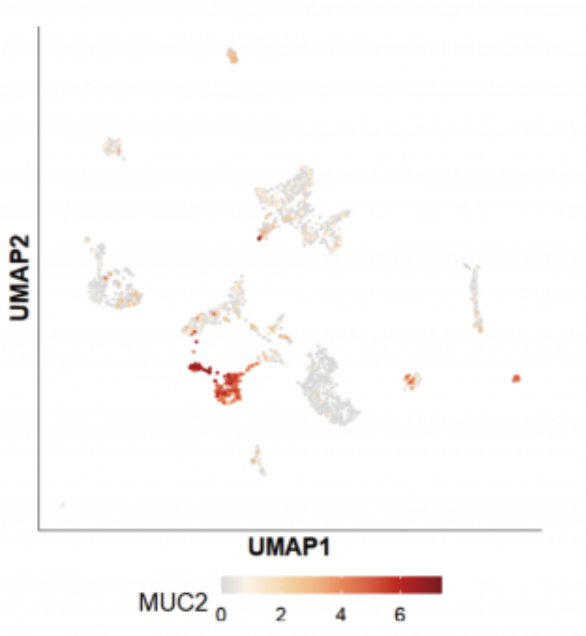
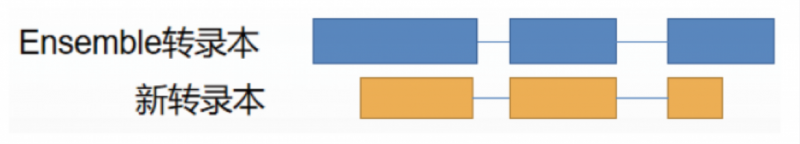
在三代全長數據中,MUC2 測到了多條 Ensemble 數據庫中未收錄的全新轉錄本:
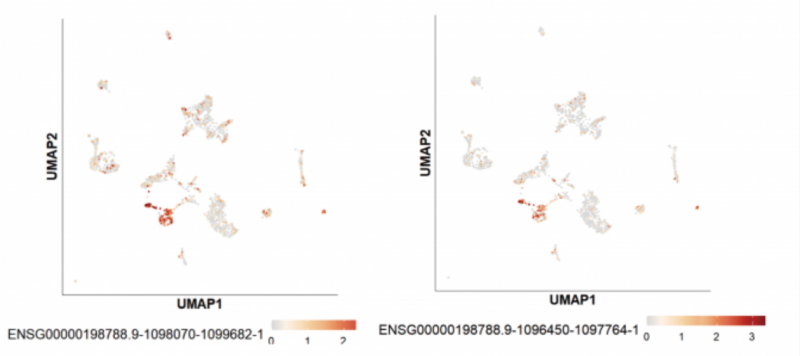
經過后續的序列比對(如下圖紅色區域),發現新轉錄本是已知轉錄本的一部分序列。

示例圖如下:
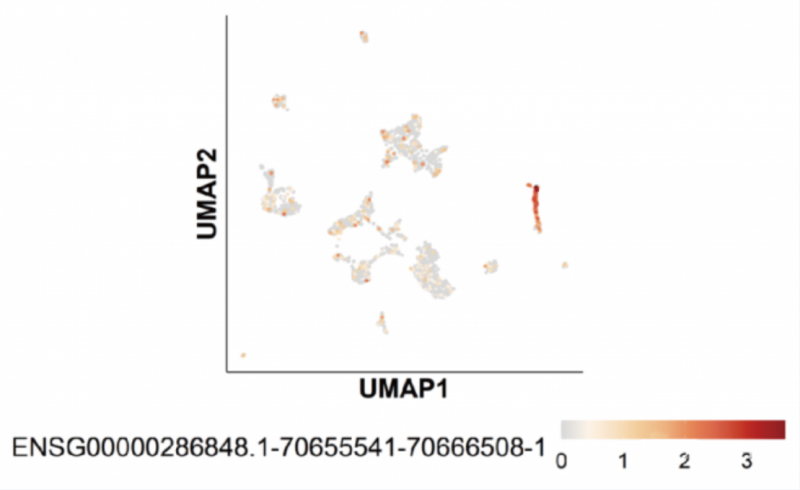
此外,全長轉錄本可以測到較多 lncRNA,下圖為 B 細胞中某條表達特異性 lncRNA:
綜合評價:
目前單細胞二代測序對基因進行表達定量的原理,是把該基因表達出來的所有轉錄本的 UM 進行求和,而三代測序是每條轉錄本進行單獨計數,如某個基因在在細胞的 count 值是 100,理論上來說,在三代轉錄本數據中,可以對應找到 100 條轉錄本 UM1。不過,就實際情況來說,最終的數據產出都是依靠測序技術,現階段的三代測序成本仍然較高,如果以比較高的投入來測非常多的三代數據是不太現實的。也就是說,只能在成本與高期望之間,選擇一個比較適中的平衡。因此,是否選擇使用單細胞全長測序技術,有如下幾個建議:
1、傳統的 Bulk-seq 研究中,借助 illumina、MGISEQ、Pacbio、Nanopore 等二代、三代測序技術同樣可以測到較多的可變剪切、融合基因、新轉錄本等。唯一讓研究者困擾的是測到的新序列太多(2000+),較難篩選過濾做后期功能驗證。單細胞全長轉錄本測序的一個優勢,是對新測到的轉錄本加上 ? 細胞亞群 ? 的標簽,可以比較快速的篩選,如腫瘤細胞、免疫細胞亞群中的特異性新轉錄本,節省下游驗證成本。這類課題是比較適合單細胞全長測序,最終結合實際數據發現特異性轉錄本。
2、如果已經指定了某個關鍵基因,想研究該基因是否在特定亞群中存在可變剪切或新轉錄本、融合基因等,比較建議先從已發表文章,或者公開數據庫(如 htps:/singlecell.broadinstitute.ore/single_cell) 中,預先査詢該基因的單細胞表達豐度。如果該基因表達量較低,并且亞群(如 T 細胞)的表達比例低于 50%,則要慎重選擇單細胞全長測序方法。解決方法是可以把這群細胞通過流式、磁珠等技術分選出來(人為富集),單獨對這群細胞進行單細胞二代 + 三代測序。
3、從上述的 MUC1 未檢測到轉錄本,而 MUC2 檢測到多條新轉錄本的例子來看,在現階段較低測序投入情況下,三代全長技術更傾向于測出來高豐度的轉錄本。從另外一個角度來說,如果某條轉錄本出現在三代全長的表達矩陣中,也就意味著該轉錄本在真實細胞中的基礎表達豐度仍然較高。這種方式相當于過濾掉了低豐度的轉錄本,這個對于 siRNA 干擾、膜蛋白、lncRNA 項目來說算是增加了個較為可信的屬性。另外,如果一定要看 MUC1 基因的轉錄本,其實可以通過 IGV 導入二代測序的 BAM 文件,直接查看該基因的原始測序序列,可以在一定程度上通過已經測到的這些 reads 來探索該 reads 分屬于哪條轉錄本(如果該基因存在多種轉錄本的話)。
4、單細胞三代全長可以直接給出來每條新轉錄本的序列,不過測序錯誤的情況也時常發生,所以后期驗證必不可少。

1、高質量標準:嚴格按 ISO9001:2015 質量標準執行;
2、標準化內控:豐富的實操經驗構建了標準化的內控體系;
3、流程化分析:完善的分析流程,準確快速解析單細胞轉錄本數據;
4、專業的團隊:專業的技術團隊具有多年項目方案設計、實驗操作、售后分析等經驗;
5、全流程服務:提供樣本處理、建庫測序及數據分析的全套服務。
伯豪生物提供:單細胞核測序、單細胞核測序技術服務

- 樣本類型: 新鮮組織,原代細胞,細胞系等。
- 樣本來源: 血液提取、磁珠富集、流式富集、組織解離等。
- 樣本量及其它質控要求:
(1)細胞懸液:>10* 目標細胞個數(最少 10,000 個細胞);活率 >85%;濃度 500-1,000 個細胞 / ul;細胞間無粘連(成團率 <5%);無大于 40um 的細胞碎片或其它顆粒物;不存在逆轉錄抑制劑和非細胞的核酸分子。
(2)血液:EDTA 抗凝的全血(不可肝素抗凝),>5ml。
(3)組織:0.3 cm × 0.3 cm(不超過 0.5cm ×? 0.5cm)的新鮮組織,4~5 塊。
- 樣本保存運輸:
(1)細胞懸液:最好現場制備,如要運輸,建議使用細胞保護液,4°C 運輸,48 小時內送達伯豪生物實驗室。
(2)血液:EDTA 抗凝的全血,4°C 運輸,4 小時內送達實驗室;或提取 PBMC 后凍存,干冰運輸。
(3)組織:建議使用單細胞專用的組織保護液,4°C 運輸,48 小時內送達實驗室。
- 捕獲細胞數及測序數據量:
| 捕獲細胞數 | 二代測序數據量 | 三代測序數據量 |
| 3000-6000(最佳建議) | 70-100G | 100G |
| 6000-8000 | 100G | 150G |
| 8000-11000 | 100G | 200G |
| 不建議超過 11000 細胞 |
- 全外測序 20G
? 伯豪生物提供:單細

| 序號 | 文件類型 | 查閱 |
| 1 | 【畫冊】單細胞全長轉錄本測序解決方案 | 點擊查看 |
| 2 | 【畫冊】石蠟樣本(FFPE)單細胞轉錄組測序解決方案 | 點擊查看 |
| 3 | 【畫冊】單細胞測序解決方案 | 點擊查看 |

